Volejte zdarma 800 108 999 v pracovní dny od 08:00 do 15:00
POŠTOVNÉ A BALNÉ NEÚČTUJEME, JSME VÝROBCI,
OBJEDNÁVKY EXPEDUJEME NÁSLEDUJÍCÍ PRACOVNÍ DEN
16. Listopad 2015
U člověka i ostatních živočichů jsou pojivové tkáně s podpůrnou nebo mechanicky odolnou strukturou přizpůsobeny specifické biologické funkci. Rozhodující význam má přitom makromolekulami organizace kolagenové složky. Kolagen přítomný ve šlachách, kůžích a kostech vytváří fibrily poměrně tlusté, které se dále spojují do objemných vláknitých svazků. Naproti tomu kolagen chrupavky vytváří jemné sítě z tenkých fibril. Tyto různé makromolekulami struktury jsou tvořeny odlišnými, geneticky určenými typy kolagenu.
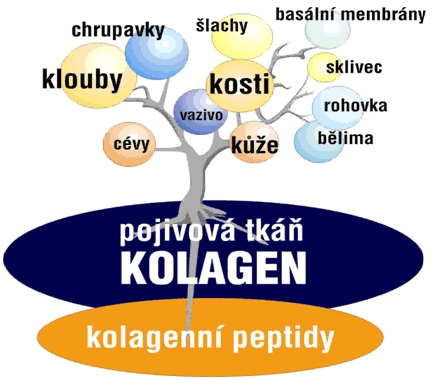
Kolagen tvoří strukturu kostí, vazů, šlach, kůže a také chrupavky. Dodává jí pevnost a pružnost (při představě tlumiče působí jako tělo tlumiče a jeho pružina).

Kolagen je základní stavební bílkovinou tvořící pojivové tkáně pohybového aparátu. ¨
Představuje 30 % všech tělních bílkovin a tvoří 70 % sušiny kloubních chrupavek. Kolagen je vláknitá, ve vodě nerozpustná bílkovina, jejíž zásluhou naše těla, která jsou ze 70 % voda, nejsou tekutá resp. kapalná. Z toho je vidět, jak velký význam má kolagen pro strukturu a integritu našich těl. Kolagen tvoří základ bílkovinné matrix kostí, chrupavek, kloubů, cév, kůže, sklivce, bělimy, synoviálních membrán atd. Tvorba kolagenních vláken tvořících strukturu kloubních chrupavek začíná v chrupavkových buňkách (chondrocytech) řazením jednotlivých aminokyselin do bílkovinných řetězců. Základní řetězce přirovnatelné ke šňůrce korálků se následně seskupují do trojšroubovice prokolagenu. Ten se transportuje z buněk, kde je dále upraven na kolagenový monomer. Monomery se řadí za a vedle sebe do mikrofibril a následně do kolagenních fibril a do kolagenních vláken. Výslednou strukturu lze tak přirovnat k lanu.
Soustava kolagenních vláken, jakýchsi kolagenních lan, tvoří nosnou arkádovitou kostru celé chrupavky. Pouze pojivová tkáň dobře nasycená kolagenem s pevnou arkádovitou strukturou se může správně vyvíjet a následně mnohem lépe odolává okamžitému i dlouhodobému přetěžování. Právě díky podpoře kolagenu může plně fungovat složka amorfní, jejíž součástí jsou proteoglykany, v nichž se vyskytuje chondroitinsulfát. Aby amorfní složka chrupavky lépe udržovala potřebný obsah vody a chrupavka tak byla lépe vyživována, potřebuje silnou a neporušenou arkádovitou strukturu vytvářenou kolagenem. Zdravě vystavěná a řádně vyživená chrupavka pak lépe odolává mechanické zátěži. Je dobré vědět, že chrupavky musí odolávat velkým nárazům, které při běhu či skoku dosahují zatížení až několika set kilogramů na 1 cm2. Při opakovaných nárazech vznikají v chrupavce mikrotrhliny, které jsou začátkem poškození chrupavky. V poškozené chrupavce dochází k destrukci kolagenních i proteoglykanových molekul. Chrupavka pak ztrácí svoji pevnost a pružnost a dochází k její destrukci, ztenčování až úplnému vymizení. Závažné poškození chrupavky se projevuje zvýšenou citlivostí a později bolestmi kloubů, rozvojem osteoartrózy. A právě zde dochází k potřebě klouby opravit, regenerovat. Nejprve je třeba zregenerovat kolagenní strukturu chrupavky a to umí pouze sám naštěpený kolagen, tedy kolagenní peptidy, které dodávají chrupavkovým buňkám potřebné stavební látky a také informace směřující k syntéze fyziologického typu kolagenu. Stejné tedy organizmus opravuje stejným, tedy kolagen kolagenem.
Kolagen je nejrozšířenějším živočišným fibrilárním proteinem, který se objevuje již v embryonálním stádiu, kdy je zodpovědný především za strukturální vývoj buněk. V lidských tkáních bylo nalezeno více než 11 různých typů kolagenů, celkově u živočichů rozeznáváme 27 kolagenních typů. Kolagen je významnou složkou vnitřního podpůrného mechanismu kostí, chrupavek, šlach, vaziva, kůže, ale také cévních stěn, rohovky a dalších tělních orgánů. Obsahují jej všechny pojivové tkáně. Nejhojněji jsou zastoupené kolageny typů I – V.
Od osmdesátých let jsou u živočichů objevovány stále nové kolagenní struktury. Nejdůležitější jsou pak tyto čtyři struktury - primární, sekundární, terciární a kvartérní.
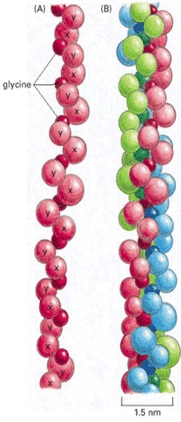
Primární struktura popisuje sekvenci aminokyselin v peptidovém řetězci, popisuje charakter peptidových vazeb a znázorňuje polohu, počet a charakter vedlejších vazeb. Molekula kolagenu je tvořena hlavně aminokyselinami glycinem, prolinem, hydroxyprolinem a hydroxylysinem. Poslední dva vznikají posttranslační modifikací prolinu a lysinu za účasti kyseliny askorbové - vitaminu C. Kolagen se skládá z řetězců alfa 1 a alfa 2, které se jen málo liší pořadím, resp. obsahem aminokyselin. Řetězce tvoří trojitou spirálu, která se označuje jako tropokolagen. Je to základní jednotka kolagenu, dlouhá přibližně 290 nm. Obsahuje také samotný prolin, který spolu s hydroxyprolinem podmiňuje jeho sterickou rigiditu (projevuje se jako nemožnost volného otáčení okolo vazby Cα-N a ztíženým otáčením okolo vazby Cα-CO) a odlišnou orientaci polypeptidických řetězců, než je tomu v případech bílkovin obsahujících menší množství cyklických aminokyselin. Kolagen obsahuje také značné množství glycinu (330 mol/1000 mol aminokyselin), který tvoří poměrně pravidelně každou třetí aminokyselinu v sekvenci řetězců. Toto rozložení umožňuje spojení řetězců do trojité šroubovice –triplehelixu. Důležitou aminokyselinou kolagenu je také hydroxylyzin, který je významný především díky své vázanosti na cukerné složky. Charakteristická je také přítomnost tyrozinu, nahromaděného v telopeptidech (terminálních peptidech). V poměrně malém množství jsou zastoupeny leucin a izoleucin, methionin a cystein. Cystein se v kolagenu typu I vyskytuje pouze u nejnižších organismů. Methionin má svou funkci především při bronkyanovém štěpení při studiu primární struktury kolagenu. Díky studiu primární struktury kolagenu bylo zjištěno, že jsou v něm prostřídány polární a apolární oblasti, přičemž polární oblasti je možné rozdělit na obsahující bazické a kyselé aminokyseliny. V apolárních částech se pravidelně střídají sekvence Gly-Pro-R, přičemž na pozici R je možné dosadit aminokyseliny – například Hyp, Met, Ser, Ala a další. Jeden řetězec tvoří přibližně 1000 aminokyselin, celá molekula má potom přibližně trojnásobný aminokyselinový obsah.
Sekundární struktura popisuje prostorové uspořádání, jež je dáno sekvencí aminokyselin a fixováno jejich nevazebnými interakcemi. Struktura kolagenu je jako u většiny proteinů α-helix pravotočivá. Na rigidním uspořádání polypeptidového řetězce se podílí intramolekulové vodíkové vazby Cα - N a Cα – CO, vycházející z α uhlíkového atomu. Základem sekundární struktury kolagenu je levotočivá polypeptidová šroubovice se stoupáním 0,95 nm, která je svinutá do pravotočivé struktury superhelixu. Jednotlivé peptidy jsou od sebe vzdáleny 0,286 nm a celková délka řetězce je 290 nm, což je charakteristický rys právě kolagenu, neboť jinde se vyskytuje pouze u proteinů s podobnou sekvencí aminokyselin.
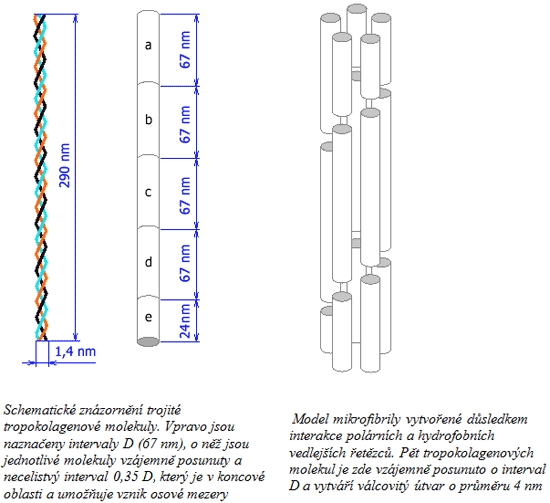
Terciární struktura kolagenu je tvořena třemi navzájem ovíjejícími se levotočivými řetězci tvořícími trojitou pravotočivou šroubovici o průměru 1,4 nm v délce 290 nm. Takto vzniklý provazcovitý útvar se nazývá tropokolagen, který je základní stavební jednotkou kolagenu. Jeho soudržnost je dána sousedícími vodíkovými vazbami, které vznikají, pouze když jsou všechny tři řetězce v těsné blízkosti. Tuto blízkost zajišťuje přítomnost glycinu.

Kvartérní struktura stanovuje kolagen jako fibrilární – vláknitou bílkovinu. Vlákna - fibrily jsou dlouhé a pevné a vyskytují se ve všech pojivových tkáních. Vlákna jsou měkká, ohebná, nepružná a vysoce pevná v tahu. Uvádí se, že 1 mm2 kolagenních vláken udrží 50 kg. Ve svazcích mají bílou barvu. Ve tkáních mohou být uspořádány do řídkých sítí nebo uspořádaných svazků (šlachy). Tloušťka kolagenního vlákna se pohybuje mezi 1-20 μm, délka může být různá Jedna molekula měří přibližně 300 nm. Při větším zvětšení v elektronovém mikroskopu se přestanou jevit jako homogenní struktura a lze vidět podélné pruhování. Nejtenčí struktura ještě rozlišitelná světelným mikroskopem se nazývá fibrila. Je tlustá 0,3-0,5 μm. Ovšem i fibrily samotné se skládají z menších jednotek, mikrofibril, které jsou pozorovatelné pouze pod elektronovým mikroskopem případně v AFM. Průměr mikrofibril se pohybuje mezi 20-100 nm, v průměru asi 75 nm. Nově vytvořené mikrofibrily měří cca 20 nm, s přibývajícím věkem se jejich tloušťka zvětšuje. Pro mikrofibrily je charakteristické příčné pruhování v intervalu 64 nm. Molekuly tropokolagenu, uspořádané v mikrofibrile v paralelních řadách, se totiž přesahují o 1/4 své délky. Místo přesahu se tak v elektronovém mikroskopu jeví tmavší. Jednotlivá vlákna je možné dále členit, a to až na mikrofibrily s uspořádáním C- konec a N- konec.
Podobně jako jiné bílkoviny, má kolagen polyelektrolytický charakter, což znamená, že se náboj molekuly kolagenu mění v závislosti na změně pH. Některé ze skupin jeho postranních řetězců ionizují v zásaditém a některé v kyselém prostředí. V silně zásadité oblasti je náboj molekuly záporný, v silně kyselé je kladný. Izoelektrický bod nacházíme při pH 7. Je to hodnota pH, při které je počet protonů připojený ke skupině -NH2 roven množství protonů odtržených od skupiny –COOH.
Další vlastností je stabilita kolagenu v hydrotermálním prostředí. Kolagenní vlákna se ve vodném prostředí zkracují přibližně o jednu třetinu. Důvodem tohoto smrštění je štěpení v intra- a intermolekulárních vazbách. Vazby tohoto typu udržují spirální stavbu v kolagenovém vlákně. Zkrácení způsobuje štěpení vodíkových vazeb, způsobené izotropními činidly. Teplota nezbytná pro tuto reakci se u savců pohybuje od 60 °C do 65 °C.
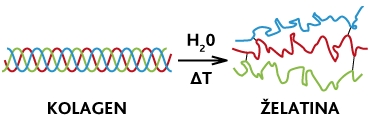
Při zahřívání ve vodním prostředí vzniká z kolagenu želatina. Při teplotě 90 °C jsou přerušeny vazby mezi polypeptidovými řetězci a kolagen pak vytvoří želatinový sol - při ochlazení pak znovu vzniká organizovaná struktura, ovšem s možnými modifikacemi. Dlouhodobým působením teploty dochází k částečné hydrolýze kolagenu - tedy ke změně jeho primární struktury, čili denaturaci. Při zpětném ochlazení želatiny vzniká opět kolagen s více či méně organizovanou strukturou. Tento proces je nazýván denaturací.
Kolageny jsou přibližně z 20% tvořeny vodou. Ta je nezbytná proto, aby byly udrženy fyzikální vlastnosti kolagenu. Ve stoprocentně hydratovaném stavu se uvolňují pohybová omezení peptidových řetězců. Proto obsahují kolageny dva druhy hydrofilních center, které tuto hydrataci zajišťují.
Prvním z nich jsou peptidické vazby kyslíku a dusíku, druhým jsou polární skupiny v řetězcích některých aminokyselin. Kolagen se z fyzikálně-chemického pohledu řadí mezi gely - koloidní soustavy, u nichž je nejdůležitější vlastností bobtnání. Při ponoření do vodného prostředí kolagenní vlákna omezeně bobtnají. První příčinou je hydratace hydrofilních center (popsaných výše), jedná se o tzv. hydratační vodu, která je odstranitelná pouze sušením. Druhou příčinou je bobtnací voda, tu lze odstranit mechanicky. Sloučeniny, odpovědné za toto bobtnání, mohou mít schopnost štěpit vodíkové vazby, popřípadě rozpouštět kolagen (při vysoké teplotě ve vodném prostředí).
DŮLEŽITÉ: Z výše uvedeného vyplývá, že stravitelnost, vstřebatelnost a využitelnost nativního nenaštěpeného kolagenu (typů I, II, III) je velmi obtížná, neboť ten ve své nativní formě podléhá v zažívacím traktu kyselé a enzymatické pepsinové a následně alkalické trypsinové a chymotrypsinové hydrolýze. Takto získané štěpy – peptidy jsou odlišné od kolagenózou naštepeného kolagenu – KOLAGENNÍCH PEPTIDŮ GELITA® a mají jinou biogenní aktivitu.
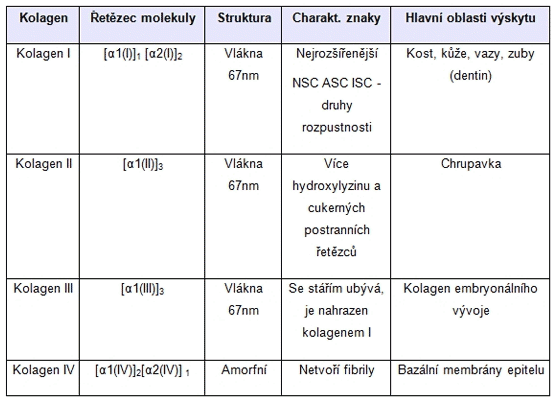
Nyní je známo 27 typů kolagenu vyskytujících se v různých tkáních a strukturách živočišných organizmu. Nejdůležitější pro výživu kloubů a i jiné praktické využití jsou kolageny typu I, II, III, IV. Tyto čtyři typy kolagenu se vyskytují v lidském organismu a plní v něm nezastupitelné role - především podpůrné.
Kolagen typu I
Kolagen typu I je v lidských tkáních nejrozšířenější, vyskytuje se především v kůži a kostech. Představuje přibližně 90% všech kolagenů v lidském těle. Sestává z jednotlivých kolagenních vláken dlouhých 1 20 µm, které mají strukturu triple-helixu, který tvoří tří polypeptidické řetězce obsahující ve velké míře aminokyseliny glycin, prolin, hydroxyprolin a hydroxylyzin. Strukturálně obsahuje dva stejné řetězce aminokyselin značené α1 a jeden řetězec odlišný – α2. Podle jeho rozpustnosti v různých prostředích jej můžeme dělit na Neutral Salt Soluble Collagen (NSC), který je rozpustný pouze v neutrálních solích, Acid Soluble Collagen (ASC), rozpustný v kyselinách a Insoluble Collagen (ISC) který je z části rozpustný při denaturaci a částečně nerozpustný]. Kolagen prvního typu je převážně přítomen v kostech, šlachách, pokožce a zubech. Tento typ kolagenu má širokospektré využití, a to nejen v potravinářské výrobě, například při výrobě potravinových doplňků vyživujících kostní tkáň, klouby, kůži, vlasy, nehty…, ale také ve výrobě kosmetických přípravků, kdy je obsažen v přípravcích proti stárnutí pokožky. Své místo má také při výrobě chirurgických nití. Je také nosičem léčiv nebo stimulujících látek, především díky svým fyzickým vlastnostem – pružnosti, vstřebatelnosti a nulové toxicitě. Ve výzkumu je používán jako podklad pro pěstování tkáňových struktur a je často využíván při výrobě tkáňových náhrad.
Kolagen typu II
Na rozdíl od kolagenu prvního typu, obsahuje tento typ více hydroxylyzinu a postranních řetězců cukrů. Je složen ze tří polypeptidických α1 řetězců a jeho vlákno je pak 67 nm dlouhé. Ze všech ostatních typů kolagenu je nejhojněji zastoupen v extracelulární matrix chrupavčitých tkání, kde přispívá k podpůrné funkci. Často je využíván ve tkáňovém inženýrství, zejména proto, že slouží jako „pletivo“, na kterém se uchycují a správně rozmisťují chondrocyty. Staví tedy pro optimální funkci chrupavky nezbytnou arkádovou strukturu. Je převážně nerozpustný. Kolagen II se nachází v chrupavkách, kde tvoří přibližně 50 % celkového objemu, resp. 70 % sušiny chrupavek.
Kolagen typu I a II (čistý, krystalický kolagen) je třeba odlišovat od kolagenního hydrolyzátu. Jedná se totiž o nativní kolagen typu I a II. Zdrojem kolagenu typu II jsou hovězí a vepřové kloubní nebo kuřecí sternální chrupavky. Kostní živočišná tkáň je nejvydatnějším zdrojem pro kolagen typu I. Čistý nativní kolagen je, na rozdíl od kolagenního hydrolyzátu, ve vodě prakticky nerozpustný. Experimentální práce na zvířatech byly prováděny především s kolagenem typu II. Ve studii Dr. Trenthama z roku 1998 bylo využito podávání malých dávek kolagenu typu II u pacientů s juvenilní revmatoidní artritidou (chronickým zánětem jednoho nebo více kloubů), které mělo za následek mírné, statisticky významné zlepšení ve skupině s kolagenem typu II. V dalších studiích opakovaných řadou odborníků byly výsledky méně příznivé.
Kolagen typu III
Dříve byl nazýván také retikulin, zejména proto, že jeho fibrily, spojené ve vlákna tvoří retikulární sítě, ve kterých jsou více či méně pravidelně uspořádány. Retikulární sítě jsou oporou měkkých tkání, proto tento typ kolagenu nalezneme především právě v nich. Příkladem mohou být hladké svalové buňky či nervová vlákna, obsažen je také ve stěnách cév. Svou stavbou je značně podobný kolagenu I, avšak obsahuje více proteoglykanů a glykoproteinů. Odlišuje jej zejména přítomnost disulfidických můstků na konci -C s vysokým obsahem hydroxyprolinu. Se stárnutím organismu tohoto kolagenního typu v tkáních ubývá a je nahrazován kolagenem typu I, proto jej nalezneme především v mladých tkáních.
Kolagen typu IV
Tento minoritní typ kolagenu netvoří ani fibrily, ani vlákna, je typem amorfním. Stejně jako předchozí typy je tvořen helikálními strukturami, k nimž jsou však připojeny také oblasti nehelikální, které jeho strukturu narušují. K jeho izolaci je vhodné použít proteolytického štěpení pepsinem. Je nazýván kolagenem bazálních membrán. Řetězce tohoto typu mají následující podoby: dva stejné řetězce α1 a jeden odlišný α2 .
DŮLEŽITÉ: Kolageny různých typů se ve tkáních vyskytují společně v různých kombinacích a poměrech. Vlivem patologických změn jsou pak různě přeměňovány. Prof. MUDr. Milan Adam, DrSc jako první na světě popsal změnu chrupavkového kolagenu typu II na typ I a III při patologických změnách v chrupavce a vliv kolagenních peptidů na příznaky osteoartrózy i distribuci kolagenních peptidů do buněk tkání kloubního systému, jejichž přítomnost v cytoplazmě prokázal imunohistochemickou detekcí. Kolageny VYTVÁŘEJÍ vlákna nebo sítě a jsou součástí všech pojivových tkání živých organismů. Efekt podávání nativního kolagenu typu I, II, III, IV u osteoartrózy resp. k výživě kloubů nebyl popsán žádnou kvalitní a nezávislou vědeckou studií.
Srovnání kolagenních typů I-IV (ostatní nejsou pro výživu kostí, chrupavek, kloubů, kůže…důležité)
Kde nás najdete?
ORLING s.r.o.
Na Bělisku 1352
562 01 Ústí nad Orlicí
IČ: 45535868
DIČ: CZ45535868
Firma zapsána v OR vedeném Krajským soudem
v Hradci Králové, spisová značka C1573
Kontaktujte nás
Užitečné odkazy